LEONOR PAULO
FÍSICO-QUÍMICA
Estados físicos e mudanças de estado
Os materiais podem encontrar-se em três estados físicos:
-
estado sólido
-
estado líquido
-
estado gasoso
Estados físicos da matéria
Caracterização macroscópia:
-
estado sólido
-
Forma: própria
-
Volume: constante (a temperatura constante)
-
Compreção: difícil
-
-
estado líquido
-
Forma: variável ( a do recipiente)
-
Volume: constante (a temperatura constante)
-
Compreção: díficil
-
-
estado gasoso
-
Forma: variável (a do recipiente)
-
Volume: variável ( o do recipiente)
-
Compreção: fácil
-
Caracterização microscópia:
-
Estado sólido
-
Forças de ligação forte
-
Pequena liberdade de movimento
-
Particulas muito próximas e organizadas
-
-
Estado líquido
-
Forças de ligação mais fracas do que nos sólidos
-
Alguma liberdade de movimento
-
Particulas muito próximas, mas muito pouco organizadas
-
-
Estado gasoso
-
Forças de ligação muito fracas
-
Grande liberdade de movimento
-
Particulas muito afastadas umas das outras e muito desorganizadas
-
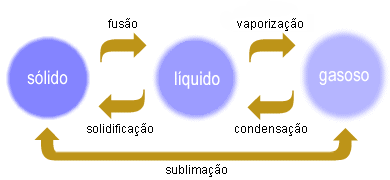
Mudanças de estado físico
Fusão - passagem do estado sólido ao estado líquido, com absorção de energia
Solidifcação - passagem do estado líquido ao estado sólido, com libertação de energia
Vaporização - passagem do estado líquido ao estado gasoso, com absorção de energia
Evaporação -passagem do estado líquido ao estado gasoso, se ocorrer lentamente e á temperatura ambiente
Ebulição - passagem do estado líquido ao estado gasoso, se ocorrer de forma rápida e tumultuosa, por aquecimento intenso
Condensação - passagem do estado gasoso ao estado líquido, com libertação de energia
Sublimação - passagem do estado sólido diretamente ao estado gasoso ou do estado gasoso diretamente ao estado sólido, com absorção de energia
Ponto de fusão e de ebulição
Ponto de fusão - é a temperatura à qual a substância passa do estado líquido, a uma dada pressão, durante a fusão de uma substância a temperatura não varia.
Ponto de ebulição - é a temperatura à qual a substância passa de forma rápida e tumultuosa do estado líquido ao estado gasoso a uma dada pressão, durante a ebulição de uma substância a temperatura não varia.
As substâncias têm pontos de fusão e de ebulição característicos.
A temperatura de fusão do gelo misturado com outra substância é inferior à temperatura de fusão do gelo.
A temperatura de ebulição de uma solução aquosa que é suparior à temperatura de ebulição da àgua.